编者按:2021欧洲心脏病学会(ESC)年会Late Breaking Science in Heart Failure公布了三项最新科学研究,本刊特邀西安交通大学第一附属医院心内科马爱群教授团队进行专题点评,与您一同深入学习。
一、研究背景
肥厚型心肌病(HCM)是一种最常见的遗传性心肌病,发病率约为1/500[1],有明显遗传倾向[2],多数表现为常染色体显性遗传,目前已发现有至少29个基因的1500多种突变可致HCM[3],其中,绝大部分位于编码肌小节结构蛋白的基因上[4],可导致左心室肥厚(LVH),心肌纤维化等,增加心力衰竭、房颤及心脏性猝死的风险。肌小节基因突变的外显率和表型具有高度异质性及年龄依赖性,在HCM疾病早期阶段往往不易被诊断。随着基因检测技术的进步,HCM高危肌小节基因突变可在出现临床症状、心肌发生不可逆变化之前被早期识别。
动物实验表明,转化生长因子β(TGF-β)的激活在HCM早期发病机制中起着重要的作用[5],血管紧张素Ⅱ与其1型受体的结合可激活典型和非典型TGF-β信号转导通路,刺激胶原合成及抑制胶原降解[6],ARB可抑制血管紧张素Ⅱ与其1型受体的结合、抑制TGF-β激活[2],从而抑制HCM的疾病进展[7](图1)。在LVH出现之前,ARB治疗可减缓LVH和纤维化的进展。
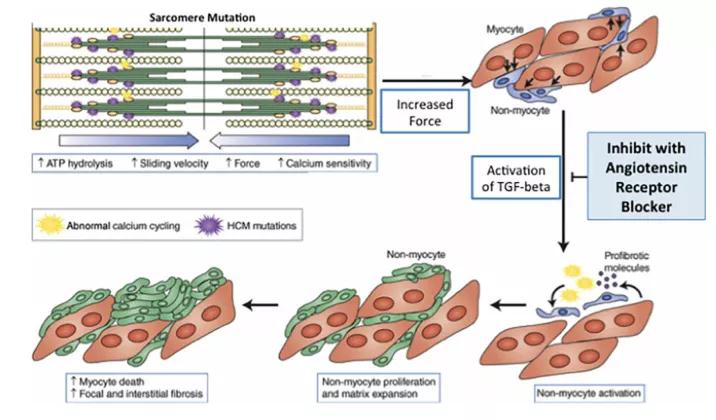
图1 肌小节基因突变致HCM及ARB对其潜在影响的模型图
HCM疾病早期,肌小节基因突变增加了收缩力和钙敏感性,即心肌肥厚发生之前促纤维化途径已被激活,异常激活的TGF-β信号通路,导致心肌肥大和纤维化,而此时ARB可抑制TGF-β激活、减缓LVH和纤维化的进展
先前的ARB临床试验均是用于已确诊HCM的成年患者,未发现明显临床获益[8-13]。ARB早期应用是否可以临床获益?
VANISH试验目的:旨在验证ARB用于携带肌小节基因突变的HCM患者,在无LVH或无明显临床症状的疾病早期阶段,是否可减缓HCM的进展的研究。
二、研究方法
VANISH研究是一项多中心、随机、安慰剂对照、双盲的临床试验。纳入患者均携带HCM致病性或可能致病的肌小节基因突变,共两个队列,即主要分析队列(HCM早期疾病阶段)和探索性队列(HCM临床前阶段)。
主要分析队列:由8~45岁肌小节基因突变携带者组成,伴有LVH,无症状或症状较轻(NYHAⅠ-Ⅱ级),为疾病早期阶段。
探索性队列:由10~25岁的肌小节基因突变携带者组成,受试者的左室壁厚度正常(未诊断HCM),但伴有如舒张功能受损(组织多普勒E峰速率降低)、心电图异常(Q波或ST段改变)等。
两个队列中受试者随机分为缬沙坦组(80-320mg/d,剂量取决于年龄和体重)和安慰剂组,治疗24个月;主要终点是反应心肌结构、功能和损伤/应激等方面的9项不同检测指标。
具体纳入和排除标准详见表1,具体试验设计及试验方案详见图2。
表1 纳入和排除标准
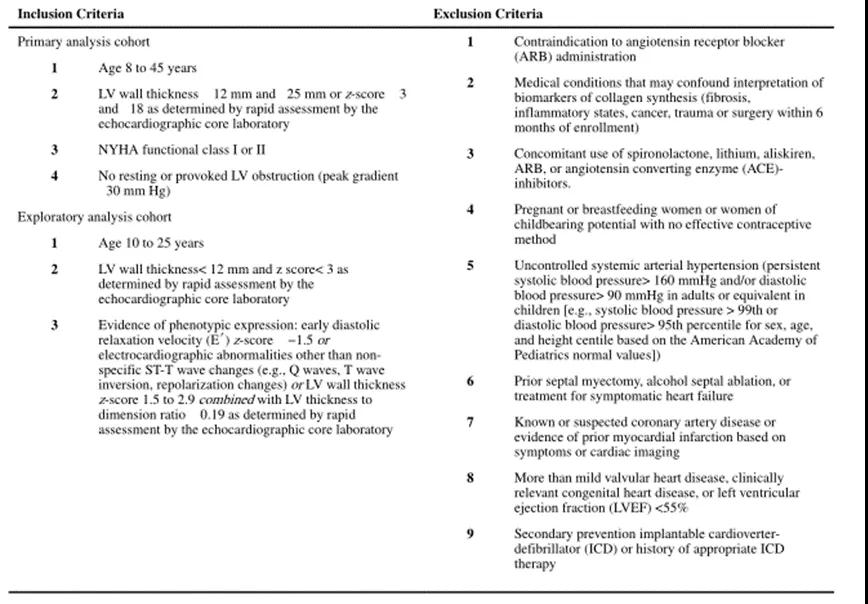
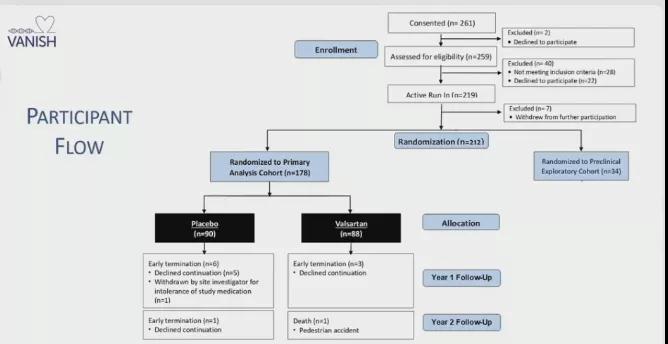
图2 试验设计及方案
三、研究结果
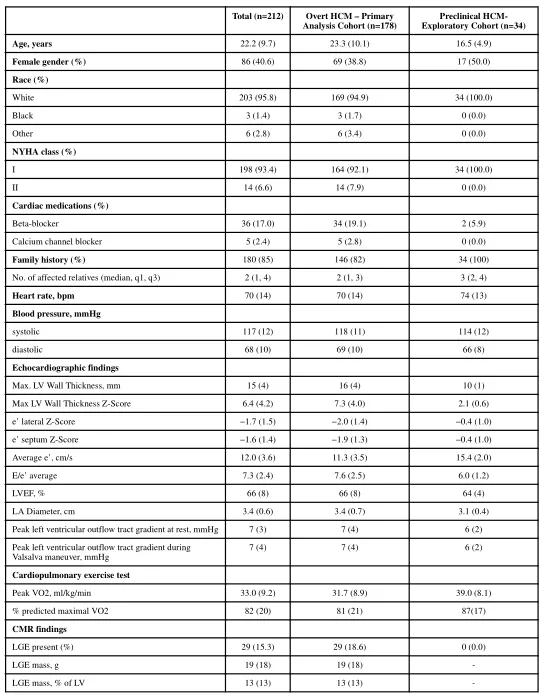
1、共212名受试者平均年龄22.2±9.7岁,女性占40.6%,NYHA Ⅰ级占93.4%。其中,178名(84%)伴有LVH,被纳入主要分析队列,34名(16%)具有正常的左心室壁厚度,被纳入探索性队列。两组受试者基线资料详见表2;
表2 两组基线资料
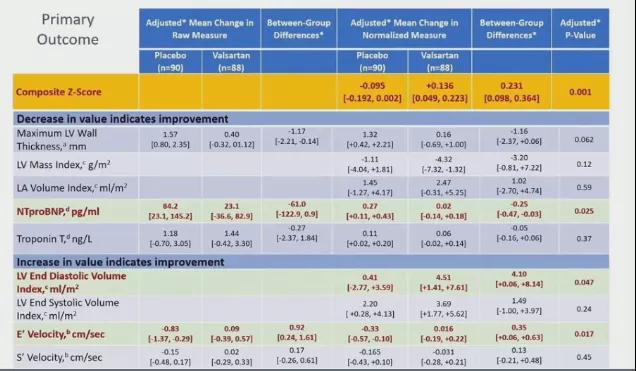
2、主要分析队列中,与安慰剂相比,缬沙坦改善了患者的主要终点具有统计学意义(P=0.001)(表3);
3、与安慰剂相比,缬沙坦对于受试者NT-proBNP水平、组织多普勒E峰速率、左室舒张末期容积的影响最大(P=0.025、0.017、0.047)(表3);
表3 主要终点结果比较
4、缬沙坦治疗安全性、耐受性良好,无不良事件(图3);

图3 缬沙坦的用药安全性
5、与先前的HCM临床试验相比,VANISH试验受试者均携带致病性或可能致病的肌小节基因突变,是首个包括临床前HCM(无LVH)受试者的试验,也是首个包括儿童和青少年受试者的HCM试验,其受试者数量较之更多且来源于多国多中心、研究时间更长。
四、研究解读
《中国心血管健康与疾病报告2020概要》[14]显示我国人群HCM患病粗率为0.16%,成人HCM患者超过100万[15],我国HCM患者心血管死亡年发生率约为1.7%[16],是35岁以下患者心脏性猝死最常见的原因。HCM目前已经是危害我国居民健康常见的心血管疾病。
HCM是一种渐进性发展疾病,在出现相关体征及症状之前不易被诊断,但基因检测技术可将其早期识别,大力推进HCM患者及其血缘亲属基因检测是提高HCM早期诊断率的有效方法,也是HCM防治的重要前提。
药物治疗是否可减缓HCM进展或改善其临床结局?哪种治疗方法更为有效?是多年困扰临床、亟待解决的问题。
VANISH试验首次证实了ARB用于携带致病性或可能致病的肌小节基因突变HCM的早期阶段,可减缓HCM的进展,并促进其病情的改善,不仅回答了早期治疗可以减缓HCM进展、可能改善其临床结局的问题,还为HCM防治,特别是早期诊断早期治疗提供了重要理论依据。
但是其他药物如β受体阻滞剂、主要作用于心脏的钙拮抗剂、其他RAS系统拮抗剂等等是否有效?哪一种方法更优?目前尚不清楚。
VANISH作为目前首个包括HCM儿童和青少年受试者的HCM试验,为HCM年轻群体患者提供了一种早期有效干预的治疗选择。必须强调的是该试验结果是来自HCM早期无症状或者症状较轻患者,这一结果是否可以向HCM有临床症状的人群延伸目前尚不清楚。
该试验的局限性:首先,HCM病理生理学演变通常需要数年至数十年,需要对大量患者进行长期随访,而该试验目前随访时间仅2年且受试者人数较少,平均年龄较小,预计的终点事件结果可能存在偏倚;其次,该试验主要终点是9项反应心脏结构、功能等的临床指标,但其与HCM临床预后的关系尚不明确;再次,缬沙坦的目标有效剂量的选择较为困难,该试验研究理论基础来源于动物实验,其有效剂量较难转换为人类所需的有效剂量。因此,我们期待该试验后期更全面、更长久的跟踪研究,观察其治疗的长期影响,观察更多的临床指标及主要终点事件。
▼参考文献
1.Maron, B. J.; Gardin, J. M.; Flack, J. M.; Gidding, S. S.; Kurosaki, T. T.; Bild, D. E., Prevalence of hypertrophic cardiomyopathy in a general population of young adults. Echocardiographic analysis of 4111 subjects in the CARDIA Study. Coronary Artery Risk Development in (Young) Adults. Circulation 1995, 92 (4), 785-9.
2.Alfares, A. A.; Kelly, M. A.; McDermott, G.; Funke, B. H.; Lebo, M. S.; Baxter, S. B.; Shen, J.; McLaughlin, H. M.; Clark, E. H.; Babb, L. J.; Cox, S. W.; DePalma, S. R.; Ho, C. Y.; Seidman, J. G.; Seidman, C. E.; Rehm, H. L., Results of clinical genetic testing of 2,912 probands with hypertrophic cardiomyopathy: expanded panels offer limited additional sensitivity. Genet. Med. 2015, 17 (11), 880-8.
3.Wilcox, J. E.; Hershberger, R. E., Genetic cardiomyopathies. Curr. Opin. Cardiol. 2018, 33 (3), 354-362.
4.Seidman, C. E.; Seidman, J. G., Identifying sarcomere gene mutations in hypertrophic cardiomyopathy: a personal history. Circ. Res. 2011, 108 (6), 743-50.
5.Kim, J. B.; Porreca, G. J.; Song, L.; Greenway, S. C.; Gorham, J. M.; Church, G. M.; Seidman, C. E.; Seidman, J. G., Polony multiplex analysis of gene expression (PMAGE) in mouse hypertrophic cardiomyopathy. Science 2007, 316 (5830), 1481-4.
6.Lopez, B.; Gonzalez, A.; Diez, J., Circulating biomarkers of collagen metabolism in cardiac diseases. Circulation 2010, 121 (14), 1645-54.
7.Teekakirikul, P.; Eminaga, S.; Toka, O.; Alcalai, R.; Wang, L.; Wakimoto, H.; Nayor, M.; Konno, T.; Gorham, J. M.; Wolf, C. M.; Kim, J. B.; Schmitt, J. P.; Molkentin, J. D.; Norris, R. A.; Tager, A. M.; Hoffman, S. R.; Markwald, R. R.; Seidman, C. E.; Seidman, J. G., Cardiac fibrosis in mice with hypertrophic cardiomyopathy is mediated by non-myocyte proliferation and requires Tgf-beta. J. Clin. Invest. 2010, 120 (10), 3520-9.
8.Araujo, A. Q.; Arteaga, E.; Ianni, B. M.; Buck, P. C.; Rabello, R.; Mady, C., Effect of Losartan on left ventricular diastolic function in patients with nonobstructive hypertrophic cardiomyopathy. Am. J. Cardiol. 2005, 96 (11), 1563-7.
9.Kawano, H.; Toda, G.; Nakamizo, R.; Koide, Y.; Seto, S.; Yano, K., Valsartan decreases type I collagen synthesis in patients with hypertrophic cardiomyopathy. Circ. J. 2005, 69 (10), 1244-8.
10.Penicka, M.; Gregor, P.; Kerekes, R.; Marek, D.; Curila, K.; Krupicka, J.; Candesartan use in, H.; Non-obstructive Cardiomyopathy Estate Study, I., The effects of candesartan on left ventricular hypertrophy and function in nonobstructive hypertrophic cardiomyopathy: a pilot, randomized study. J. Mol. Diagn. 2009, 11 (1), 35-41.
11.Shimada, Y. J.; Passeri, J. J.; Baggish, A. L.; O’Callaghan, C.; Lowry, P. A.; Yannekis, G.; Abbara, S.; Ghoshhajra, B. B.; Rothman, R. D.; Ho, C. Y.; Januzzi, J. L.; Seidman, C. E.; Fifer, M. A., Effects of losartan on left ventricular hypertrophy and fibrosis in patients with nonobstructive hypertrophic cardiomyopathy. JACC Heart Fail 2013, 1 (6), 480-7.
12.Yamazaki, T.; Suzuki, J.; Shimamoto, R.; Tsuji, T.; Ohmoto-Sekine, Y.; Ohtomo, K.; Nagai, R., A new therapeutic strategy for hypertrophic nonobstructive cardiomyopathy in humans. A randomized and prospective study with an Angiotensin II receptor blocker. Int. Heart J. 2007, 48 (6), 715-24.
13.Axelsson, A.; Iversen, K.; Vejlstrup, N.; Ho, C.; Norsk, J.; Langhoff, L.; Ahtarovski, K.; Corell, P.; Havndrup, O.; Jensen, M.; Bundgaard, H., Efficacy and safety of the angiotensin II receptor blocker losartan for hypertrophic cardiomyopathy: the INHERIT randomised, double-blind, placebo-controlled trial. The Lancet Diabetes & Endocrinology 2015, 3 (2), 123-131.
14.中国心血管健康与疾病报告编写组, 中国心血管健康与疾病报告 2020 概要. 中国循环杂志 2021, 36 (276), 521-544.
15.Zou, Y.; Song, L.; Wang, Z.; Ma, A.; Liu, T.; Gu, H.; Lu, S.; Wu, P.; Zhang dagger, Y.; Shen dagger, L.; Cai, Y.; Zhen double dagger, Y.; Liu, Y.; Hui, R., Prevalence of idiopathic hypertrophic cardiomyopathy in China: a population-based echocardiographic analysis of 8080 adults. Am. J. Med. 2004, 116 (1), 14-8.
16.Wang, J.; Wang, Y.; Zou, Y.; Sun, K.; Wang, Z.; Ding, H.; Yuan, J.; Wei, W.; Hou, Q.; Wang, H.; Liu, X.; Zhang, H.; Ji, Y.; Zhou, X.; Sharma, R. K.; Wang, D.; Ahmad, F.; Hui, R.; Song, L., Malignant effects of multiple rare variants in sarcomere genes on the prognosis of patients with hypertrophic cardiomyopathy. Eur. J. Heart Fail. 2014, 16 (9), 950-7.
专家简介
马爱群教授
医学博士,博士生导师,二级教授/一级主任医师,教育部骨干教师,陕西省“35”人才,陕西省卫生厅“215”人才。现任陕西省分子心脏病学重点实验室主任,陕西省心血管疾病质量控制中心主任,陕西省全科医学会主任委员,中华医学会全科医学分会常务委员,《中国分子心脏病学杂志》副主编,《中华心力衰竭和心肌病杂志》副总编辑。主要研究方向为心力衰竭、心血管离子通道病及心血管疾病精准医学的应用研究。先后主持科技部科技惠民计划1项、科技部国际科技合作项目1项、国家自然科学基金4项(重点项目1项,面上项目3项)、卫生部科研基金4项、教育部项目3项及陕西省自然科学基金4项;共发表论文300余篇,其中SCI收录130多篇(H因子为24),主编专著9部,主编国家临床(助理)医师执业资格考试系列丛书6部,主译专著1部,参编专著5部;获得国家实用新型专利1项,软件著作权2项。先后获陕西省科学技术奖一等奖2项、二等奖1项,中华医学科技奖三等奖1项及其他厅级科技成果奖4项;先后指导毕业博士研究生65名,硕士研究生70名。